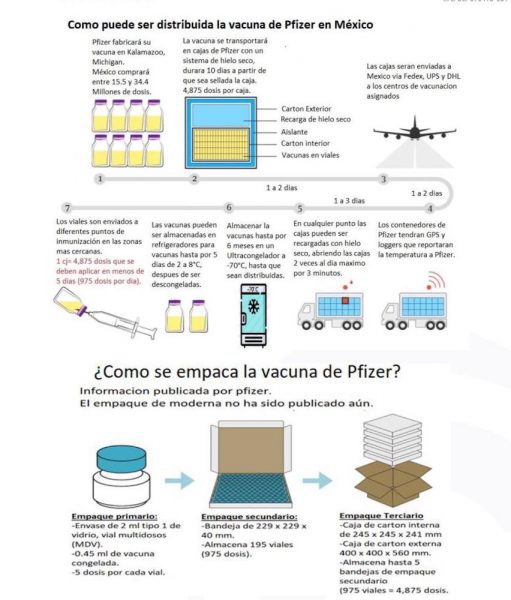
Las primeras 250 mil dosis de la vacuna Pfizer llegarían a México entre el 15 y 16 de diciembre por vía aérea provenientes de Kalamazoo, Michigan, Estados Unidos, donde concluye el proceso de formulación, relleno y acabado de dicho biológico, aunque aún no se resuelve el problema de la ultracongelación, informaron fuentes sanitarias.
Las dosis de ARNm COVID-19 (BNT162b2) estarán empaquetadas en contenedores y la distribución será a través de avión, por Fedex, UPS y DHL (contratados por Pfizer) y la propuesta es que lleguen al Aeropuerto Internacional de Toluca, aunque no se descartan otras rutas como Ciudad de México y Querétaro.
¿Cómo es el proceso de envío?
Si se respeta el calendario preestablecido para arrancar la campaña nacional de vacunación contra el covid-19, la primera entrega de las vacunas estará empaquetada en cajas con hielo seco que alcanzan -75 grados centígrados. Se trata de 51 a 52 cajas especiales que contendrán 4 mil 875 dosis cada una como máximo.
Cada envase contiene 0.45 mililitros, aunque puede haber envases de multidosis de dos mililitros. Estos contenedores solo se pueden abrir dos veces al día para colocar hielo seco y por tres minutos porque se puede alterar la sustancia activa del biológico.
Una vez que se abre el sello de la bandeja del contenedor, las autoridades sanitarias de México tendrá un máximo de 10 días para aplicar las dosis o resguardarlas en la tradicional red de frío.
Se pueden colocar en una red de frío de dos a ocho grados centígrados, pero por cinco días. Si se pasa de ese periodo, existe una alta probabilidad de que el frasco se rompa. Además, una vez que se descongela la vacuna se debe de aplicar en de seis a ocho horas. Las segundas dosis, después de aplicar las primeras, se deben de inyectar en 21 días.
Considerando el tiempo máximo de 10 días de conservación en los contenedores de Pfizer y los cinco días adicionales en la red de frío de dos a ocho grados, se desconoce aún dónde serán depositados los biológicos para aplicar la segunda dosis 21 días después. La indicación de la vacuna es aplicar las dos dosis en 21 días. Esto significa que quedan seis días descubiertos para preservar de manera correcta la vacuna contra el covid-19.
Ultracongelación, pendiente
Hasta el momento, las autoridades no han resuelto la adquisición de los ultracongeladores, considerando que el equipo de mayor tamaño puede almacenar más 146 mil dosis por seis meses. Son ultracongeladores que tienen un costo de 320 mil pesos, aunque también hay de China que cuestan 210 mil pesos con la diferencia de que se demora 60 días en entregar los pedidos.
Cada contenedor tendrá sensores térmicos y GPS de localización que estarán en contacto con la torre de control que rastreará en todo momento la ubicación de las vacunas en tránsito. Estará cubierto por una caja de cartón externa.
Se prevé que el 10 de diciembre la FDA de Estados Unidos otorgue el registro de uso de emergencia a Pfizer y México podría otorgarlo ese mismo día o bien al siguiente. Luego pasarán cinco días naturales para trasladar a México el primer lote de 250 mil dosis de las 34.4 millones adquiridas bajo contrato con la Secretaría de Salud (Ssa).
¿A quién se vacunará primero?
Serán los profesionales de la salud los primeros candidatos a la vacuna, con dos dosis por persona y se está considerando al Ejército.
Una vez que lleguen los 51 o 52 contenedores, con las 250 mil dosis, la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) evaluará las condiciones en las que llegarán las vacunas, medirá desde temperatura hasta su integridad física, es decir, que no estén derramadas o vaciadas.
Cuando la vacuna obtenga el registro sanitario en México, la Cofepris se encargará de que se lleven a cabo pruebas que reportan el Certificado de Análisis del Producto para cada lote. Los resultados de estas pruebas son realizados por un cuerpo colegiado asesor de la Ssa.
La agencia regulatoria mexicana, que obtuvo el reconocimiento de autoridad nacional de productos biológicos y medicamentos por parte de la Organización Panamericana de la Salud (OPS), también hará toda una evaluación técnica-científica de la documentación de la producción de las vacunas.
Certificará que todos los procesos de producción, desde materias primas hasta producto terminado, se hayan hecho en establecimientos que cuenten con el Certificado de Buenas Prácticas de Fabricación (NOM-059-SSA1-2013). También, la Cofepris analizará la estabilidad y los estudios clínicos que certifican la seguridad y eficacia de las vacunas. Su labor es avalar la calidad del producto.
Para liberar los lotes, la Cofepris realizará una evaluación analítica sobre el producto terminado, es decir, pruebas para verifica que los resultados que se obtengan concuerden con el Certificado de Análisis de Producto, y que estén dentro de las especificaciones. En esta etapa se corroborará que el producto terminado sea seguro y eficaz.
De esta manera la Cofepris cumplirá con su misión de evaluar la calidad de las materias primas utilizadas para la producción de las vacunas, el proceso de producción, el transporte y almacenamiento de los biológicos. Las vacunas pasarán por tres filtros de seguridad antes de llegar a la población.
En este momento, la autoridad sanitaria no ha detallado a qué centros sanitarios específicos trasladará los contenedores que lleguen de la vacuna Pfizer, pero se dará a conocer el próximo martes cuando se presente el Plan Nacional de Vacunación contra el SARSCoV2 en México.
Vacuna tiene eficacia de 95%
El hecho de que la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) de Reino Unido emitiera una autorización temporal para el uso de emergencia la vacuna de Pfizer y de BioNTech sienta un precedente para que la farmacéutica produzca el biológico con base a las peticiones que hagan los diferentes países.
Solo a Reino Unido entregará 40 millones de dosis entre 2020 y 2021, y se encuentra a la espera de la autorización de la FDA, el 10 de diciembre, y de la EMA de la Unidad Europea.
En un comunicado, Pfizer informó que la decisión de la MHRA se basó en los datos del estudio clínico de Fase 3 que demostró una tasa de eficacia de la vacuna de 95 por ciento en participantes sin infección previa por SARSCoV2, el primer objetivo principal. Y también en participantes con y sin infección previa por SARSCoV2, lo cual se midió siete días después de la segunda dosis.
“La eficacia fue constante en todos los datos demográficos de edad, sexo, raza y etnia, con una eficacia observada en adultos de 65 años o más de más de 94 por ciento. No se informó problemas graves de seguridad”, de acuerdo con Pfizer.